XVI Congresso Nazionale AMD
I lavori scientifici del XVI Congresso nazionale AMD hanno avuto interessanti sessioni in contemporanea di incontri con l’esperto. A moderare quello sull’inizio della terapia insulinica nel diabete di tipo 2 Domenico Cucinotta (Messina), che ha introdotto l’argomento. Alberto De Micheli (Genova), per il Gruppo di Lavoro Intersocietario AMD/SID, ha presentato un inquadramento epidemiologico del fallimento della terapia con ipoglicemizzanti orali (c.d. secondary failure), evento di non univoca e agevole caratterizzazione, ma definibile come la “perdita di efficacia di dieta, attività fisica e degli ipoglicemizzanti orali nel mantenimento del compenso glicemico”. Generalmente ci si riferisce al fallimento secondario della terapia orale (dopo un periodo di efficacia), misurabile attraverso i parametri disponibili (glicemia, HbA1c) e in assenza di condizioni interferenti (assunzione di farmaci diabetogeni, assenza di compliance, ecc.): fenomeno che richiede l’aggiunta di un altro farmaco o il passaggio a un’altra forma di terapia (in genere, quella insulinica). Proprio le difficoltà di definizione del problema limitano l’analisi della letteratura disponibile, che consta di una ventina di studi prospettici o retrospettivi estremamente eterogenei sia nei parametri considerati sia nei dati raccolti (Figura 1).
Il fallimento secondario della monoterapia orale, in questi studi, si verifica in una percentuale di casi variabile tra il 15 e l’87% dei casi, a seconda della molecola considerata e della durata del follow-up; De Micheli ha sottolineato come il fenomeno colpisca più i secretagoghi insulinici che gli insulino-sensibilizzanti, o le associazioni terapeutiche. L’aggiunta di una sulfonilurea o di un glitazone alla metformina consente nel 60% dei casi di tornare a un livello accettabile di compenso, che tuttavia risulta transitorio nel 40% di questi. La tripla associazione, infine, avrebbe un’incidenza di secondary failure variabile tra l’11 e il 49%. Alcuni indicatori clinici possono risultare predittivi della velocità con cui si giunge al fallimento secondario (età alla diagnosi e livelli di emoglobina glicosilata in tale epoca, basso peso alla diagnosi, presenza di segni di diabete autoimmune, mancanza di educazione o di compliance, aspetti genetici) [http://www.cmecorner.com/macmcm/aace/aace2002_04.htm].
Rispondendo alle domande dell’audience, De Micheli ha ricordato che la determinazione del c-peptide (basale o dopo stimolo) non sembra fornire informazioni predittive, e che non esistono dati in merito all’eventuale efficacia della sostituzione di una sulfonilurea con un’altra, in un’insufficienza secondaria.
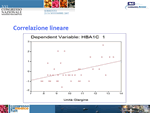
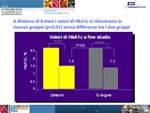
Sergio Di Pietro (Roma) ha poi presentato i dati di uno studio che aveva lo scopo di cercare di comprendere se le caratteristiche fenotipiche e/o il grado di compenso metabolico dei diabetici tipo 2 in secondary failure possano indicare la dose di analogo insulinico ad azione prolungata che diventa necessario aggiungere agli ipoglicemizzanti orali, per ottenere un compenso metabolico ottimale e stabile. Lo studio è stato condotto su 40 diabetici in fallimento secondario (grave scompenso da almeno 6 mesi; anni di malattia: 14,43 +/- 9,1). Di tutte le variabili considerate, si è evidenziata una correlazione positiva solamente tra livelli di HbA1c e posologia di glargine necessaria per ottenere un buon compenso dopo 3 e 6 mesi di terapia (r=0,44; p<0,01). In tal senso, suggerisce Di Pietro, l’HbA1c sembra poterci indirizzare alla dose insulinica necessaria a medio termine, mentre la valutazione di parametri più sofisticati e costosi non pare al momento giustificata (Figura 2).
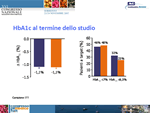
È stato poi il turno di Raffaella Gentilella (Firenze), che ha presentato un’analisi post-hoc di uno studio registrativo sull’exenatide, incretino-mimetico per il trattamento del diabete di tipo 2. Gli autori hanno confrontato l’ormone con l’insulina glargine su un totale di 549 soggetti, in fallimento secondario con metformina + sulfoniluree, durante un periodo di trattamento di 26 settimane. Il protocollo dello studio prevedeva la prosecuzione della terapia di associazione orale, cui si aggiungeva exenatide in bi-somministrazione giornaliera (titolazione da 5 a 10µg x 2/die) o glargine in monosomministrazione serale (partendo da 10 U/die e aumentando la posologia settimanalmente, fino a ottenere livelli glicemici vicini alla norma). Le caratteristiche basali dei pazienti erano simili, e i due trattamenti hanno consentito di raggiungere livelli analoghi di riduzione dell’HbA1c e di numero di pazienti a target (Figura 3).
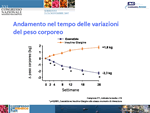
Alcune differenze sono state invece registrate nel monitoraggio dei profili glicemici, con una copertura analoga a digiuno, ma una migliore performance di exenatide nei periodi post-prandiali; inoltre, la terapia con l’incretino-mimetico si è associata a un importante effetto di riduzione del peso (differenza media exenatide – insulina glargine: -4,1 kg; IC 95%: da -4,6 a -3,5 kg) (Figura 4).
I due regimi terapeutici sono stati ben tollerati, con una bassa incidenza complessiva di eventi ipoglicemici; in particolare l’exenatide ha ridotto gli episodi notturni, e la glargine quelli diurni. L’incretino-mimetico ha provocato (come effetto collaterale) episodi di nausea, soprattutto nelle prime settimane di somministrazione. In sostanza, l’exenatide a dose fissa è risultata efficace quanto la glargine a dose titolata nel migliorare il controllo glicemico dei pazienti valutati, con alcune caratteristiche vantaggiose che ne fanno un’interessante alternativa terapeutica.
L’intervento successivo, presentato da M. Amodio, presentava uno studio di efficacia su una miscela di un analogo insulinico rapido + NPL Mix-50, condotto da diversi diabetologi territoriali campani. Lo studio riprendeva i dati preliminari di un lavoro di Kazda e coll. (Diabetes 2004), nel quale la triplice somministrazione quotidiana dell’analogo in questione consentiva di ottenere, in soggetti con diabete di tipo 2 in cattivo compenso, un controllo glicemico significativamente migliore rispetto ad altri schemi terapeutici, senza alterare il profilo di sicurezza. Gli autori hanno arruolato 297 pazienti (HbA1c >/=7,5%; età 25-70 anni; durata di malattia >/=8 anni), considerando come endpoint primario il raggiungimento di un target glicemico </=180 mg/dl. Tra i criteri d’inclusione, l’assunzione regolare di tre pasti al giorno. La posologia della miscela insulinica, somministrata in una quota pari al 50% al pasto principale e il resto suddiviso tra colazione e cena, è stata titolata settimanalmente, valutando l’autocontrollo glicemico dei pazienti. Lo schema analizzato ha consentito di ottenere il miglioramento del controllo glicemico a 3-6 mesi (in termini di HbA1c e di glicemia post-prandiale), con un’incidenza di episodi ipoglicemici addirittura ridotta rispetto ai controlli. Secondo Amodio lo schema proposto, se adeguatamente controllato, riesce a normalizzare i valori glicemici in fase interprandiale e post-prandiale, realizzando un’insulinizzazione ottimale e costante nel tempo sia in pazienti che intraprendono per la prima volta il trattamento insulinico, sia in soggetti precedentemente trattati con schemi differenti (Figura 5 e Figura 6).
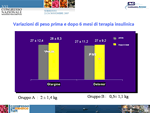
L’intervento di Donatella Zavaroni (Piacenza) aveva per oggetto il confronto tra detemir (bis in die) e glargine in monosommistrazione (in associazione a ipoglicemizzanti orali: repaglinide e metformina), nel trattamento di 68 pazienti con diabete di tipo 2 in scarso compenso glicemico (HbA1c > 8.5%). I livelli di HbA1c a 6 mesi, utilizzati come endpoint primario, si sono ridotti nei due gruppi in maniera sovrapponibile (p=ns per il confronto), con oltre il 50% di pazienti a target alla valutazione conclusiva. I pazienti del gruppo detemir hanno tuttavia sperimentato un miglior effetto sul peso, a scapito della duplice somministrazione quotidiana, senza differenze in termini d’incidenza di episodi ipoglicemici (Figura 7 e Figura 8).
L’incontro si è concluso con l’intervento di Salvatore De Cosmo (San Giovanni Rotondo), per il Gruppo di Lavoro Intersocietario AMD/SID, che ha relazionato sulle attuali evidenze relative alla terapia insulinica nel fallimento degli ipoglicemizzanti orali. Sono stati presentati i dati relativi all’inserimento di insulina in uno schema con secretagoghi, insulino-sensibilizzanti o entrambe le molecole. Proponendo i dati di una metanalisi di JL Johnson e coll. (Arch Med Int 1996), il relatore ha ricordato come l’aggiunta di insulina alla terapia con sulfoniluree consenta di migliorare i livelli di glicemia post-prandiale e di HbA1c, a scapito di un aumento del peso corporeo. Per quanto riguarda la metformina, a meno di specifiche controindicazioni, questa dovrebbe sempre essere mantenuta con l’inserimento dell’insulina. Diverso è il caso dei glitazoni, per i quali, nonostante alcuni effetti incoraggianti, l’EMEA invita a proporre l’associazione con insulina solamente in casi eccezionali. In merito a quale insulina aggiungere a uno schema orale, entrambi gli analoghi lenti disponibili avrebbero un profilo d’azione vantaggioso, se confrontati con la NPH. Lo studio 4-T (Treating To Target in Type 2 Diabetes; N Engl J Med 2007) ha recentemente valutato diversi schemi di insulinizzazione (bifasica, prandiale o basale), in aggiunta alla terapia orale, su 708 pazienti. Il confronto sembra premiare le insuline short-acting prandiali. Inserendo l’insulina, in aggiunta agli ipoglicemizzanti orali, le possibilità a nostra disposizione sono 2: l’impiego di uno schema basal-bolus e quello delle insuline pre-miscelate. Uno dei primi studi di confronto in questo senso è quello recentissimo di J Rosenstock e coll. (Diabetes Care 2007). De Cosmo ha concluso la discussione ricordando l’importanza di mantenere un adeguato stile di vita.